Quantenphysik
Die Quantenphysik beschreibt beispielsweise Atome, Licht sowie deren Wechselwirkungen. Weil wir im Alltag kaum direkte Erfahrungen mit Quantenobjekten haben, erscheint uns ihr Verhalten manchmal seltsam. Dennoch haben quantenphysikalische Vorgänge Konsequenzen, die uns alle angehen (Laser, Elektronik, ..).
Photonen
Max Planck hat 1900 in seiner Theorie der Wärmestrahlung angenommen, dass Licht und Materie Energie in Portionen (Quanten) austauschen. Albert Einstein hat 1905 den äusseren Photoeffekt dadurch erklärt, dass Licht aus "Korpuskeln" (Photonen) besteht.
Energie eines Photons:
h = 6.626 070 15·10-34 Js (Planck'sches Wirkungsquantum)
f: Frequenz des Lichts / der elektromagnetischen Strahlung (c = λ·f)
Beim äusseren Photoeffekt wird beobachtet, dass Licht Elektronen aus Metallen "herausschlagen" kann. Der Effekt tritt erst ab einer bestimmten Frequenz auf, nämlich wenn ein Photon genügend Energie hat, um ein Elektron aus dem Metall herauszulösen (Bindungsenergie, Austrittsarbeit). Über dieser Schwelle nimmt die Energie der freigesetzten Elektronen linear mit der Frequenz des Lichtes zu. Der Effekt ist unabhängig von der Intensität des Lichtes.
Beim inneren Photoeffekt wird ein Elektron im Innern eines Stoffes freigesetzt, z.B. entsteht ein Elektron-Loch Paar am pn-Übergang einer Photodiode, wenn man diese beleuchtet.
Beim inversen Photoeffekt z.B. in einer LED (Leuchtdiode) wird ein Photon frei, wenn ein Elektron-Loch Paar rekombiniert.
Im Jahr 1916 hat A. Einstein bestimmte Eigenschaften der Wärmestrahlung dadurch erklärt, dass er den Photonen einen Impuls zuschrieb:
p = h/λ
Wenn ein Atom ein Photon aussendet, so erhält es deshalb einen messbaren Rückstoss.
Weil Photonen Impuls haben, erzeugen Sie einen Strahlungsdruck der Grösse 2·J/c, wenn sie senkrecht auf einen Spiegel fallen. Dabei ist J die Energieflussdichte (Watt pro Quadratmeter)
Materiewellen
Wenn eine Welle (Licht) Teilcheneigenschaften hat, sollte dann nicht umgekehrt Materie auch Welleneigenschaften haben? (L. de Broglie, 1923)
λ ist die Wellenlänge dieser "Materiewellen" und p ist der Impuls des Teilchens. Bald nach Veröffentlichung dieser Hypothese hat man Beugung von Elektronenstrahlen nachweisen können.
Man kann auch zusammengesetzten Objekten, z.B. ganzen Atomen oder Molekülen, eine einzige Wellenlänge zuordnen. Diese Wellen zeigen Interferenz- und Beugungsphänomene.
Rutherford'sches Atommodell
E. Rutherford durchstrahlte Goldfolien mit Alphateilchen und stellte dabei fest, dass Atome einen kleinen, massiven, positiv geladenen Kern haben. Er veröffentlichte sein Atommodell 1911. Mit späteren Ergänzungen sieht es so aus:
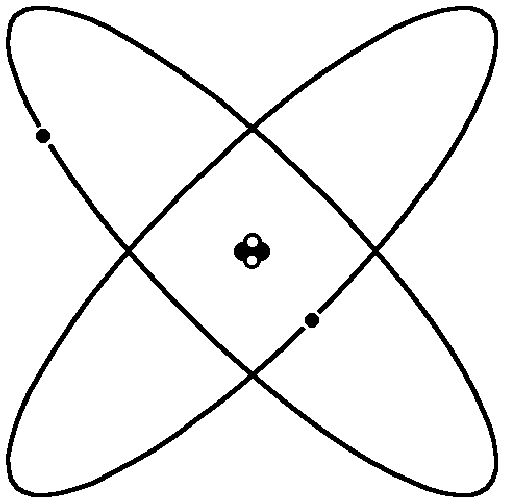
Abbildung: "Planetenmodell" eines Atoms à la Rutherford
Ein Atom besteht aus einem Kern und einer Hülle. Die Hülle ist der Bewegungsraum der Elektronen und hat eine typische Grösse von 10-10 m. Der Kern hat eine typische Grösse von 10-15 m. Er besteht aus Protonen und Neutronen (= Nukleonen). Ein Nukleon hat eine Masse von 1.66·10-27 kg (≈ 1 u), ein Elektron ist etwa 2000 Mal leichter. Der Kern eines neutralen Atoms enthält ebenso viele Protonen wie die Hülle Elektronen.
Bohr'sches Atommodell
Niels Bohr konnte 1913 einige Eigenschaften des Wasserstoffatoms erklären, indem er eine Quantisierungsbedingung einführte. In der Version von de Broglie (1923) ist die Quantisierung leicht zu verstehen:
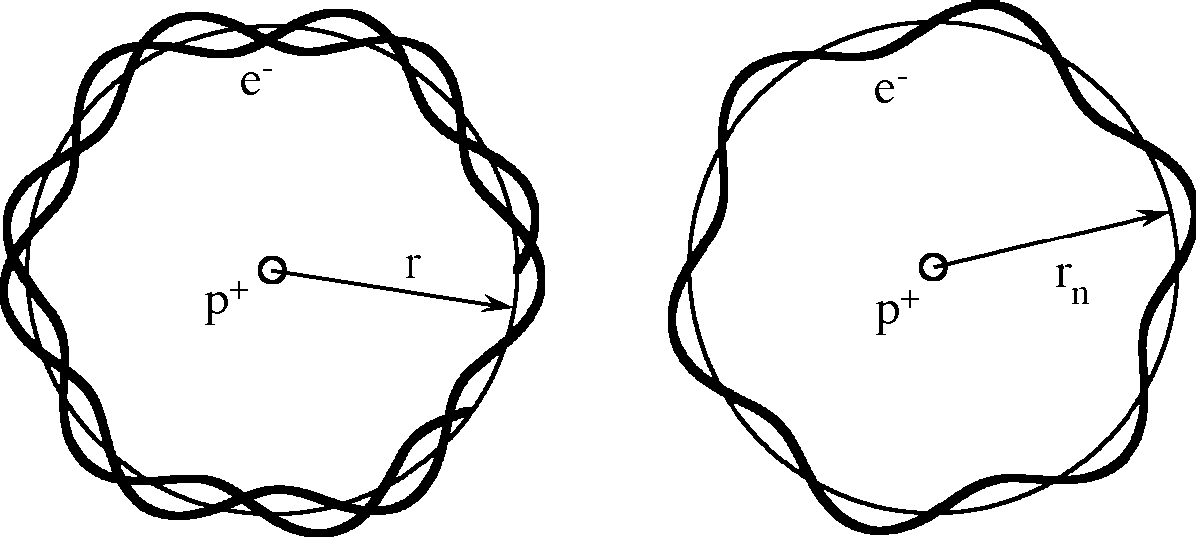
links: nicht möglich rechts: "erlaubt"
Abbildung: Die Wellenlänge muss zur Bahnlänge passen (Quantisierungsbedingung). Wenn sich die Wellenfunktion, die zum Elektron gehört, nicht schliesst, dann hat die Wellenfunktion keinen eindeutigen Wert und das ist nicht möglich.
1. Das Elektron bewegt sich gleichmässig auf einer Kreisbahn um das Proton. Die resultierende Kraft ist gleich der Coulombkraft und bewirkt die Zentripetalbeschleunigung.
2. Die Wellenfunktion, die zum Elektron gehört, hat eine Wellenlänge wie von de Broglie beschrieben.
3. Die Bahnlänge muss ein ganzzahliges Vielfaches der Wellenlänge sein:
2·π·rn = n·λ (Quantisierungsbedingung nach de Broglie)
Die natürliche Zahl n heisst Hauptquantenzahl.
Mit den genannten Beziehungen kann man die erlaubten Bahnradien berechnen. Man erhält:
rn = n2·r1 wobei
r1 ≈ 5.29·10-11 m (Bohrscher Radius)
Bohr konnte die Grösse von Atomen erklären! Wie wir aber vom jüngeren Orbitalmodell her wissen, muss man diese Aussage mit einem Körnchen Salz geniessen.
Es ist auch möglich, die Gesamtenergie (kinetische und elektrostatische, potenzielle Energie) eines Elektrons auf der n-ten Bahn zu berechnen:
En = E1/n2 wobei
E1 ≈ -13.6 eV (Grundzustandsenergie)
Die Energien sind negativ, weil das Elektron ans Proton gebunden ist. Man muss Energie zuführen, um das Atom zu ionisieren. Ein ruhendes Proton und ein weit entferntes, ruhendes Elektron haben Gesamtenergie Null. Die Ionisationsenergie ist 13.6 eV. Das Atom befindet sich meistens im energetisch tiefsten Zustand n = 1 (Grundzustand).
Quantensprung
Das Atom kann nur gewisse Zustände einnehmen, aber es kann Übergänge zwischen diesen Zuständen machen. Früher hat man gesagt, das Elektron könne auf eine andere Bahn springen (Quantensprung). Man kann das Atom aber nie während des Übergangs beobachten, da die Zwischenzustände ja nicht möglich sind! Bringt man viele Atome in einen angeregten Zustand, so wird die Zahl der angeregten Atome mit der Zeit exponentiell abnehmen und die Zahl der Atome im Grundzustand wird entsprechend zunehmen. Die Übergänge selbst sind unbeobachtbar, sie finden quasi augenblicklich statt.
Spektrallinien
Das Licht einer Gasentladungslampe enthält nur wenige Wellenlängen. Nach Bohr lässt sich das einfach erklären: Das Atom kann von einem energetisch höheren Nivau m auf ein tieferes mit Hauptquantenzahl n springen und die Energiedifferenz einem Photon mitgeben. Umgekehrt kann ein Photon passender Energie das Atom auf ein höheres Energieniveau bringen, wenn es absorbiert wird.
|En-Em| = h·f (Bohr'sche Gleichung)
Setzt man die Formel für die Energie ein, verwendet c = f·λ und fasst alle Konstanten zusammen, so erhält man die Rydbergformel für die Spektrallinien des Wasserstoffatoms:
λ-1 = R∞·(n-2 - m-2)
R∞ ist die Rydbergkonstante "für unendlich grosse Kernmasse" (gemeint ist ein unendlich träger Kern, der unbeweglich im Zentrum liegt).
Ein Spezialfall ist die Balmerformel: Jene Übergänge, die auf demselben Niveau enden, werden zu einer Serie zusammengefasst. Die Balmerserie mit Endniveau n = 2 liegt als einzige im sichtbaren Bereich. Johann Jakob Balmer war Basler Gymnasiallehrer.
Für andere als das H-Atom gibt es keine handliche Formel mehr. Einelne Atome habe aber relativ wenige Spektrallinien, die charakteristisch für das Atom sind. Moleküle haben sehr viel mehr Spektrallinien, die sich teilweise zu Bändern überlagern. Der Absorptionsverlauf im Bandenspektrum ist typisch für das Molekül.
Unbestimmtheitsrelationen
Werner Heisenberg fand heraus, dass es Paare von Messgrössen gibt, die nicht gleichzeitig genau bestimmt sein könnnen.
Ort-Impuls-Unbestimmtheitsrelation:
∆x·∆px ≥ h/4π
Energie-Zeit-Unbestimmtheitsrelation:
∆E·∆t ≥ h/4π
Die Ort-Impuls-Unbestimmtheitsrelation hat zur Folge, dass keine exakten Bahnen mehr möglich sind: Nur wenn zu Beginn Ort und Impuls (Geschwindigkeit) genau bekannt sind, kann man im Prinzip eine Bahn angeben. Der Aufenthaltsort eines Quantenobjekts ist also prinzipiell unbestimmt.
Die Energie-Zeit Unbestimmtheitsrelation kann benützt werden, um aus der beobachtbaren Energieunschärfe eines Prozesses, z.B. dem Zerfall eines instabilen Teilchens, auf dessen Dauer zu schliessen, d.h. auf die Lebensdauer des instabilen Teilchens oder des angeregten Zustandes. Je stabiler der Zustand ist (je länger er lebt), desto genauer ist die Energie bestimmt.
Vorgänge mit ∆E·∆t < h/4π kommen zwar vor, sind aber nicht direkt beobachtbar. Beispielsweise kann aus dem Nichts ein Elekton-Positron-Paar auftauchen. Falls es wieder verschwindet, bevor es beobachtet werden kann, ist auch kein physikalisches Gesetz verletzt. Man nennt dies virtuelle Prozesse.
Tunneleffekt
Quantenmechanisch kann ein Teilchen Dinge tun, die ihm nach klassischer Physik verwehrt wären. Ein frühes und wichtiges Beispiel dazu ist der Tunneleffekt.
Beispiel: U-238 kann sich in Th-234 umwandeln, indem es ein Alphateilchen aussendet. Das Alphateilchen hat eine kinetische Energie von 4.2 MeV. Schiesst man nun ein Alphateilchen mit dieser Energie gegen einen Thoriumkern, so kann es den Kern niemals erreichen. (Es kommt klassisch auf neun Atomkernradien heran.)
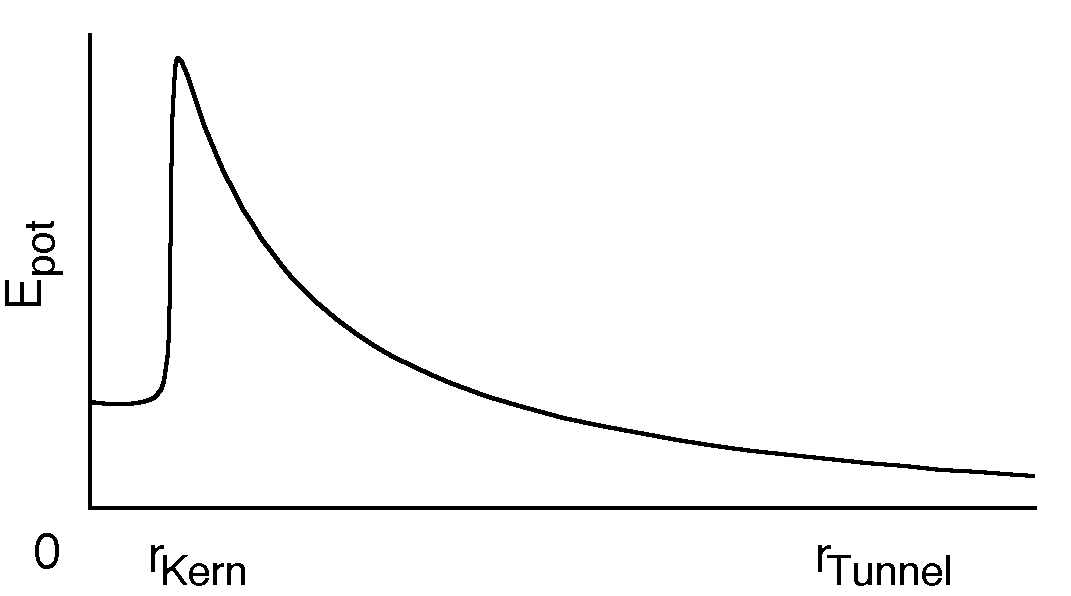
Abbildung: Die potenzielle Energie des Alphateilchens im Feld des Thoriumkerns hat etwa diese Form. Das Alphateilchen hat nicht genug Energie, um den "Potenzialberg" zu übersteigen. Es muss sich einen "Tunnel gegraben haben".
Nach der Heisenbergschen Unbestimmtheitsrelation ist das Tunneln möglich, falls der Vorgang schnell genug abläuft, weil dann die Energie des Alphateilchens genügend unbestimmt ist. Nach klassischer Physik müsste das Teilchen dann mit Überlichtgeschwindigkeit tunneln!
Beispiel: Unsere Sonne könnte kaum Kernfusion betreiben, wenn der Vorgang nicht durch den Tunneleffekt ermöglicht würde.
Laser
"Laser" ist eine Abkürzung für "Light Amplification by Stimulated Emission of Radiation".
Albert Einstein hat bei der Analyse der Wärmestrahlung herausgefunden, dass es einen Vorgang geben muss, den er stimulierte Emission nannte:
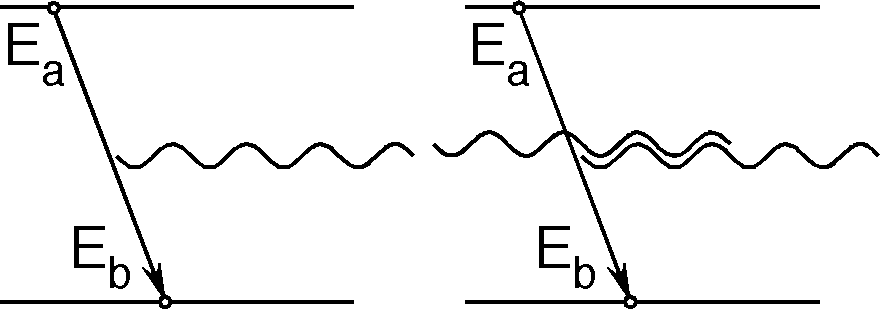
Abbildung: Bei der spontanen Emission (links) geht das System, z.B. ein angeregtes Atom, ohne äusseren Anlass in einen energetisch tieferen Zustand über und gibt die Energiedifferenz einem Photon mit. Trifft ein Photon passender Energie auf ein angeregtes System (rechts), so kann es den Übergang auslösen (stimulieren). So entsteht ein zweites Photon mit exakt denselben Eigenschaften wie das auslösende.
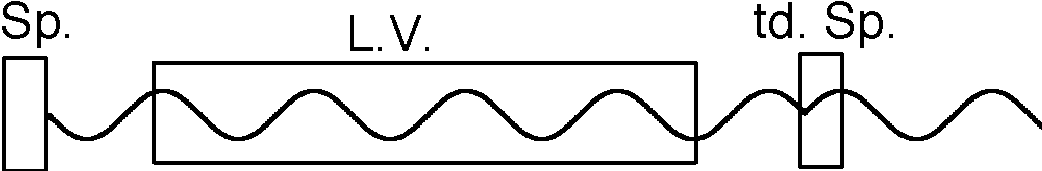
Abbildung: Ein Lasergerät enthält ein aktives Medium, das stimulierte Emissionen machen kann, zwischen zwei Spiegeln. Licht, das zufällig die passende Frequenz und Richtung hat, wird zwischen den Spiegeln hin und her geschickt und dabei fortwährend verstärkt. Einer der Spiegel ist teildurchlässig: Dort kommt dann der Laserstrahl heraus. Die zwei Spiegel haben noch einen weiteren Zweck: Die Wellenlänge des Lichtes muss zum Spiegelabstand passen; damit wird die Wellenlänge besser eingeschränkt als durch den atomaren Übergang. Der Spiegelabstand muss ein ganzzahliges Vielfaches der halben Wellenlänge sein, damit sich eine stehende Lichtwelle bilden kann.
Laserlicht ist deshalb sehr beliebt, weil es monochromatisch ist und sich gut bündeln lässt. Laser können stark oder schwach, kontinuierlich oder gepulst sein.
Ergänzungen: Zusatz
erste Version: 12. Oktober 2008, Revisionen: 13.10.2008, 4. Juli 2013, 27. Juli 2023 / Lie.
Zurück zur Startseite des Repetitoriums



